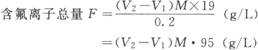(1)方法原理 在弱酸性溶液中,氯离子能和铅及氟离子定量地生成氟氯化铅PbClF沉淀。 F-+C1-+pb2+→PbClF↓ 过量的铅盐标准溶液将沉淀过滤,测定溶液中过量的铅,计算氟离子的总量。 (2)试剂 ①0.75%氯化钾溶液; ②氨水1+5; ③10%酒石酸钾钠溶液; ④10%氰化钾溶液; ⑤pH l0缓冲溶液; ⑥铬黑T指示剂; ⑦0.05mol/L的EDTA标准溶液; ⑧0.1mol/L硝酸铅标准溶液; ⑨EDTA-Mg溶液,取0.05mol/L氯化镁(MgCl2·6H2O10.2g溶于lL水中)20mL,加水20mL,pHl0缓冲溶液lomL,铬黑T少许,以0.05mol/L的EDTA滴定至蓝色; ⑩0.1%溴酚蓝指示剂,0.1g溴酚蓝溶于0.05mol/L氢氧化钠3mL,加水97mL,(pH3~4.6黄一蓝)。 (3)分析步骤 ①取镀液lmL于250mL烧杯中; ②加氯化钾溶液100mL; ③加溴酚蓝数滴; ④加l+5氨水中和至蓝色; ⑤移入250mL容量瓶中; ⑥加0.1mol/L硝酸铅溶液100mL,加水至刻度摇匀,放置30min; ⑦干滤纸过滤至50mL容量瓶中(相当于原液0.2mL); ⑧取滤液50mL于250mL锥形瓶中,加水50mL; ⑨加酒石酸钾钠10mL(使锡生成络合物); ⑩加pill0缓冲液10mL; (11)加l0%氰化钾溶液l0mL(络合镍和杂质金属离子,以消除其干扰); (12)加EDTA-Mg溶液5mL,(使指示剂终点清晰); (13)用0.05mol/L EDTA标准溶液滴定至蓝色为终点,记为消耗体积Vl(mL)。 空白试验: ①取0.1mol/L硝酸铅20mL于300mL锥形瓶中; ②加水80mL; ③加酒石酸钾钠10mL; ④加pH缓冲溶液l0mL; ⑤加EDTA-Mg溶液5mL; ⑥加铬黑T少许; ⑦用0.05mol/L的EDTA标准溶液滴定至蓝色为终点,记消耗体积为V2(mL)。 计算 式中M—EDTA标准溶液摩尔浓度; 0.2—所取镀液毫升数; 19—F相对原子质量。 氟总量包括氟化氢铵、氟化铵、氟化钠各组分中的氟含量。 |