法拉第定律 电镀过程的重要定律是法拉第定律,自1833年发现该定律迄今已170余年。 如上所述,如果电解硫酸铜溶液,则在阴极发生铜的沉积,且沉积的量由电解通过的电量的来决定。 当一种金属发生像这样的电解反应沉积或溶解时,电解涉及的反应物或产物的量与通过的电量成正比。法拉第定律定量地描述了这种关系: ①电解时金属沉积或溶解的量与通过的电量成正比。 ②通过相同电量所析出的不同金属的质量,与其电化学摩尔质量成正比。lmol质子的电荷称为法拉第常数,用F表示, F=NAe=6.023X1023/molXl.60218922X10-19C=96500C/mol 式中,NA为阿佛伽德罗常数;e为质子电荷;C为电量单位库仑。 在我们电镀行业中,习惯用"安培小时(A·h)"表示电量,1F=26.8A·h。 法拉第电解定律可用公式(1-1)来表示。 M=ItM/96500z (1-1) 式中,M和z分别为被镀金属的摩尔质量和金属离子的价数;m为通过电流I(A)经时间t(s)后析出的金属的质量,9。 式(1-1)也可改写为式(1一la): m=KIt (1一la) 式中,K为通过1A·h的电量可沉积出的金属的量,g/(A·h);t为时间,h。 不同金属的K值见表1-2。 表1-2金属电沉积的K值
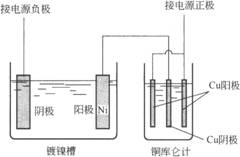
表中Au、Cu和Sn都有不同的价态,从而有不同的K值。例如,在硫酸铜中电沉积铜时,溶液中的铜是+2价,K=1.1869/(A·h);从氰化物溶液中电沉积时,K=2.3729/(A·h),因此时溶液中铜是+1价。 在电解过程中流经电解池的电量可以由不同的方法得到。为得到最精确的值,就要使用库仑计。库仑计是一个电解效率100%的电解池,使用时与被测电镀槽串联。典型的库仑计是银、铜或碘库仑计。银、铜库仑计通过称量电解沉积的银或铜的量而得到电量,碘库仑计通过滴定电解产生的碘的量来确定电量。铜库仑计使用最广泛。最近,通过电学方法测量电量的多种库仑计已经问世。 (一)铜库仑计 铜库仑计使用的电解质每升含有l50g硫酸铜、50g硫酸和50mL乙醇,两块电解铜板用作阳极,采用已称重的铜板作为阴极,电流密度为20~200A/m2,通二氧化碳气轻微搅拌溶液。图1-2为使用铜库仑计的示意图。
图1-2测量电流效率的线路 (二)电流效率 一般来说,电镀时阴极上除所需沉积金属的反应外,常伴随有副反应发生,从而浪费了部分电量。用于沉积金属的电量与总电量的比称为电镀的电流效率,也等于实际沉积金属的量与理论沉积金属量(设无副反应)之比。
|